近期,山东大学药学院张娜教授团队在Advanced Science(IF=16.806)以封面文章发表了题为“Multipoint Costriking Nanodevice Eliminates Primary Tumor Cells and Associated-Circulating Tumor Cells for Enhancing Metastasis Inhibition and Therapeutic Effect on HCC”的最新研究成果,聚焦相关循环肿瘤细胞的多点共击策略高效抑制肿瘤转移。药学院博士后牟伟伟为论文第一作者,药学院张娜教授及刘永军副教授为本论文共同通讯作者,山东大学为第一作者单位和唯一通讯作者单位。

图1杂志封面和文章首页
转移是导致肿瘤患者死亡的主要原因之一,循环肿瘤细胞(Circulating tumor cells,CTCs)是肿瘤转移的关键标志物,已成为肿瘤治疗的新靶点。消除原发肿瘤和抑制相关循环肿瘤细胞(associated-CTCs)是肿瘤治疗亟待解决的关键问题,关注CTCs的研究仍处于探索阶段,迄今尚未有同时消除原发肿瘤细胞和associated-CTCs的有效治疗系统。基于CTCs的多样性,课题组将CTCs的主要形式,包括单个CTC、CTC簇和CTC-中性粒细胞簇,统称为associated-CTC,它们是肿瘤转移和转移相关死亡的重要执行因子。因此,肿瘤治疗若能同时关注原发肿瘤细胞和associated-CTCs,不仅靶向治疗原发肿瘤,还通过特异性靶向识别捕获CTC、解离CTC簇和阻止CTC-中性粒细胞簇形成,才能有效抑制转移,提高肿瘤治疗效果。
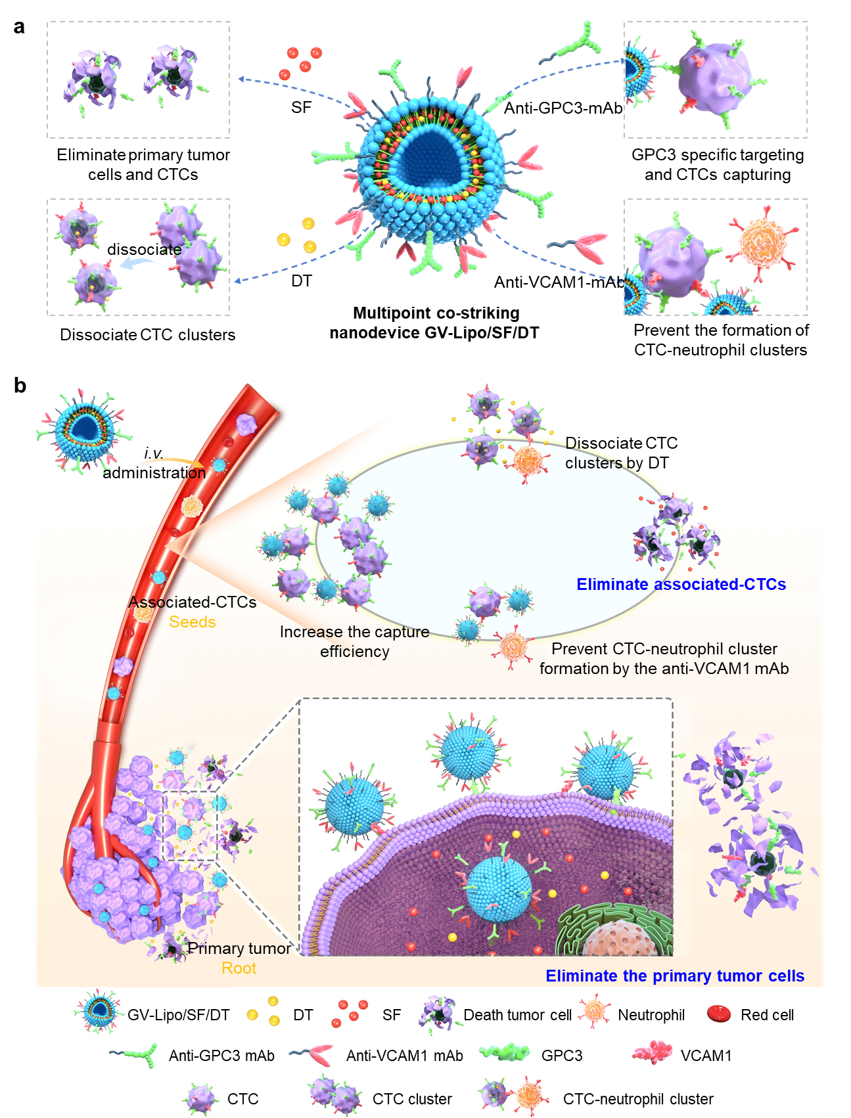
图2多点共击纳米药物(GV-Lipo/SF/DT)消除原发肿瘤和associated-CTCs增强HCC转移抑制和治疗效果的示意图
山东大学药学院张娜教授和刘永军副教授团队以具有高转移复发特性的肝细胞癌(Hepatocellular carcinoma,HCC)为治疗模型,首次聚焦associated-CTC抑制肿瘤转移,开发了一种多点共击纳米药物GV-Lipo/SF/DT,同时消除原发肿瘤并抑制associated-CTCs,增强抗转移和肿瘤治疗效果(图2)。GV-Lipo/SF/DT通过索拉非尼消除原发肿瘤细胞,从源头上减少CTC产生;通过增强HCC高特异性靶向因子磷脂酰肌醇蛋白聚糖3(glypican-3,GPC3)和/或血管细胞粘附分子1 (vascular cell adhesion molecule 1,VCAM1)的识别作用,利用洋地黄毒苷解离CTC簇,利用VCAM1单抗阻断CTC-中性粒细胞簇的形成,并利用SF杀灭CTC,多点共击彻底阻断肿瘤转移。动物实验结果表明,GV-Lipo/SF/DT显著提高了CTC的消除效率,有效抑制HCC术后复发和抑制转移,在原位HCC模型和移植模型中均显示出增强的抗肿瘤效果(图3)。多点共击策略为临床肿瘤治疗开辟一种新的抗转移治疗模式,为全方位抑制肿瘤转移开辟了新的可能性,为肿瘤患者提供了一种协同给药策略,在化疗消除原位肿瘤同时有效阻断肿瘤转移、抑制复发,极大提高抗肿瘤治疗效果。
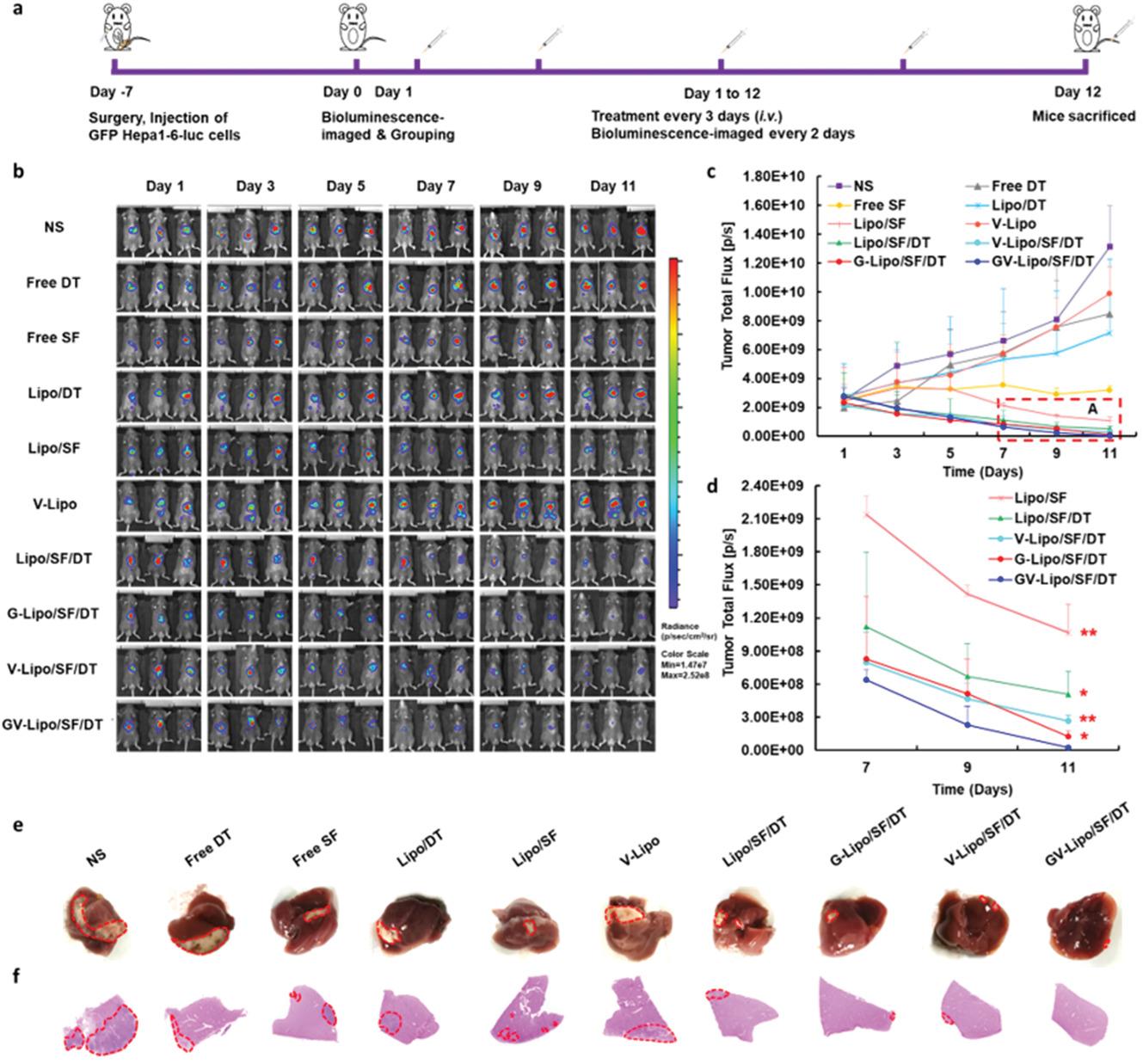
图3GV-Lipo/SF/DT显著抑制原位肿瘤生长
张娜教授团队在功能化创新药物递送研究中取得了一系列重要成果,发表于Advance Science,ACS Nano,Nano-Micro Letters,Adv. Funct. Mater.,J Control Release, Biomaterials等国际著名期刊。该研究受到国家自然科学基金(Nos. 81974498 and 81773652)的支持。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202101472
